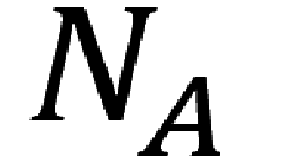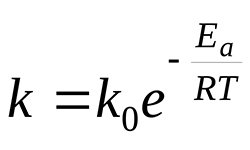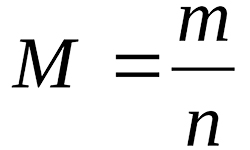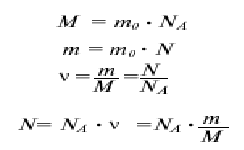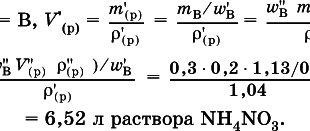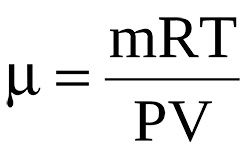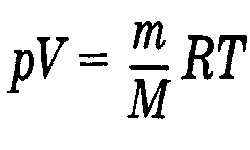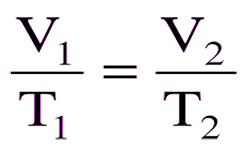Число атомов (молекул, других структурных элементов), содержащихся в 1 моле вещества, называется в химии и физике числом Авогадро (постоянной Авогадро) в честь итальянского ученого Авогадро и обозначается Na или L. На основании выведенного ученым закона рассчитывается атомная и молекулярная масса. Это — коэффициент пропорциональности между молярной массой составляющих и массой образца. …
Читать далее »Уравнение Арениуса
В мире все находится в постоянном движении. В результате постоянно происходит столкновение и взаимодействие мельчайших частиц. Однако, по утверждению Аррениуса, не все столкнувшиеся молекулы вступают в химическое взаимодействие. Столкновения станут эффективны, если молекулы имеют достаточную энергию. Минимальная энергия молекулы, способная при столкновении привести к химическому взаимодействию, является энергией активации. Сообщив …
Читать далее »Молярная масса
Отношение массы вещества (m) к количеству молей этого вещества (n) или масса 1-го моля данного вещества называется молярной массой, обозначается символом М: М = m/n Отсюда, масса вещества равняется: m = n × M количество молей вещества: n = m/М Число молекул N равняется произведению числа Авогадро на число молей …
Читать далее »Атомная масса
Относительная атомная масса — величина массы атома в атомных единицах массы. Чтобы найти атомную массу элемента, необходимо массу его атома поделить на 1/12 массы нейтрального атома изотопа углерода 12C. Учитывая, что абсолютная масса атома является невероятно малой величиной, в химии преимущественно пользуются в практических целях другой величиной — относительной атомной массой,определяющей во …
Читать далее »Молекулярная масса
Молекула — это частица с невероятно маленькой массой. Молекулярная масса представляет отношение массы одной молекулы вещества к 1/12 массы одного атома углерода-12, обозначается Мr, выражается в а.е.м. (атомных единицах массы). Молекулярная масса — масса молекулы, которая складывается из суммы масс всех атомов этой молекулы. Если непосредственно измерить массу 1 молекулы невозможно, то …
Читать далее »Разбавление раствора
Концентрация — величина, выражающая количественный состав раствора.На практике часто производиться разбавлять раствор, делать его менее концентрированным. Чтобы рассчитать степень разбавления, воспользуемся формулой: М1V1 = М2V2 V1 — объем раствора до разбавления, л, V2 — после разбавления (в литрах) М1 — концентрация раствора перед разбавлением, М2 — после разбавления (моль/л). В химии М — означает меру концентрации, …
Читать далее »Закон Бойля-Мариотта
Основной газовый закон был независимо сформулирован двумя учеными — Р.Бойлем (1662 г.) и Э. Мариоттом (1676 г.). Его назвали именем этих ученых — Закон Бойля — Мариотта. Ученые установили, что при постоянной температуре с увеличением давления газа, его объем уменьшается, т.е. объем газа обратно пропорционален его давлению при постоянной температуре. У идеального газа …
Читать далее »Молярная масса газа
Молярная масса вещества или масса 1-го моля вещества равняется массе вещества к количеству моль этого вещества. Применив уравнение состояния идеального газа, можно высчитать молярную массу газа (М), зная его параметры: массу (m), молярный объем (V), давление (Р) и абсолютную температуру (Т). PV = (m/M) T, pV = mRT / M, …
Читать далее »Закон идеального газа
Формулу, которая устанавливает зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа называют уравнением идеального газа или уравнением Менделеева — Клапейрона: РV = nRT где n – число молей газа, R – универсальная газовая постоянная, которая равняется 0,0821 л·атм/моль·K Р — давление (атм) V — объем (л) Т — температура (К) Если …
Читать далее »Закон Гей-Люссака
Закон был впервые опубликован французским ученым в 1802 г. Ж.Л.Гей-Люссаком, был назван в его честь. Это закон пропорциональной зависимости объёма газа от абсолютной температуры при постоянном давлении. V / T = const V — объем газа (куб.м) Т — температура газа (К) или: V1 / V2 = T1 / T2 отношение объемов …
Читать далее » Помощник в обучении Сайт помощник в обучении. Онлайн калькуляторы, тренажеры и справочники для решения и выполнения математических и других видов задач
Помощник в обучении Сайт помощник в обучении. Онлайн калькуляторы, тренажеры и справочники для решения и выполнения математических и других видов задач